CHEMIA KLASA VIII DZIAŁ I. KWASY
POJĘCIA
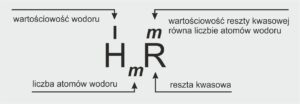
KWASY – to związki chemiczne, których cząsteczki zbudowane są z atomów wodoru i reszty kwasowej.
RESZTA KWASOWA – atom lub grupa atomów znajdujące się w cząsteczce każdego kwasu obok atomu wodoru.
KWAS BEZTLENOWY – to kwas, którego cząsteczka nie zawiera atomów tlenu.
KWAS TLENOWY – to kwas, którego cząsteczka zawiera atomy tlenu.
JAK SĄ ZBUDOWANE KWASY?
Kwasy to związki chemiczne zbudowane z kationów wodoru i anionów reszty kwasowej.
PODZIAŁ KWASÓW NIEORGANICZNYCH
KWASY NIEORGANICZNE | |
KWASY BEZTLENOWE | KWASY TLENOWE |
resztę kwasową HmR tworzą atomy niemetali | resztę kwasową HmR tworzy grupa zawierająca atomy niemetalu i atomy tlenu |
JAK TWORZY SIĘ NAZWY I WZORY KWASÓW BEZTLENOWYCH?
Nazwy kwasów beztlenowych tworzy się, dodając do słowa kwas nazwę niemetalu, który występuje w reszcie kwasowej i końcówkę -wodorowy.
PRZYKŁADY:
HCL – kwas chlorowodorowy
H2S – kwas siarkowodorowy
RODZAJ KWASU | WZÓR SUMARYCZNY | NAZWA KWASU |
kwas beztlenowy | HCL | kwas chlorowodorowy |
kwas beztlenowy | H2S | kwas siarkowodorowy |
JAK TWORZY SIĘ NAZWY I WZORY KWASÓW TLENOWYCH?
Nazwy kwasów tlenowych tworzy się, dodając do słowa kwas nazwę niemetalu, który występuje w reszcie kwasowej i końcówkę –owy.
PRZYKŁADY:
H2CO3 – kwas węglowy
H2S – kwas siarkowodorowy
Jeśli niemetal w związkach chemicznych przyjmuje różne wartości, to jego wartościowość uwzględnia się w nazwie kwasu.
PRZYKŁADY:
kwas siarkowy(IV) |
|
kwas siarkowy(VI) |
RODZAJ KWASU | WZÓR SUMARYCZNY | NAZWA KWASU |
kwas tlenowy | 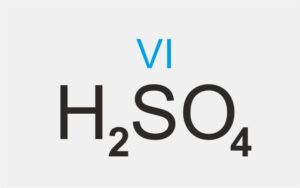 | kwas siarkowy(VI) |
kwas tlenowy | kwas siarkowy(IV) | |
kwas tlenowy |  | kwas azotowy(V) |
kwas tlenowy | 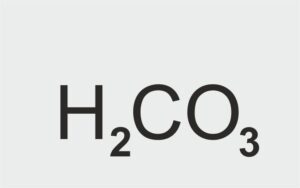 | kwas węglowy |
kwas tlenowy | 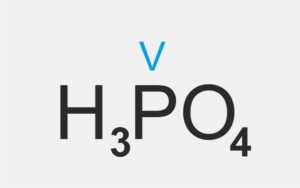 | kwas fosforowy(V) |
NA CZYM POLEGA DYSOCJACJA JONOWA KWASÓW?
– Kwasy w roztworach wodnych dysocjują na kationy wodoru i aniony reszty kwasowej.
– Kwasy zawierające w cząsteczkach więcej niż jeden atom wodoru dysocjują stopniowo.
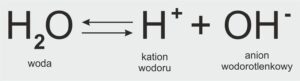
CZY WODA ULEGA DYSOCJACJI JONOWEJ?
Woda w bardzo niewielkim stopniu ulega dysocjacji jonowej według równania:
JAKIE WŁAŚCIWOŚCI MAJĄ KWASY?
– kwasy są elektrolitami (elektrolit przewodzi prąd elektryczny);
– w roztworach wodnych dysocjują na kationy wodoru i aniony reszty kwasowych;
– ich wodne roztwory przewodzą prąd elektryczny i barwią tak samo dany wskaźnik.
JAK WYKRYĆ OBECNOŚĆ KWASÓW W ROZTWORZE?
– oranż metylowy zmienia barwę z pomarańczowej na czerwoną;
– uniwersalne papierki wskaźnikowe przyjmują barwę od pomarańczowej do czerwonej.
CZYM JEST ODCZYN ROZTWORU?
Odczyn roztworu jest cechą roztworu określającą, czy znajduje się w nim nadmiar jonów wodoru H+ czy jonów wodorotlenkowych OH– lub czy ich stężenia są sobie równe.
Odczyn roztworu określa się za pomocą wskaźników:
– odczyn kwasowy liczba H+ > OH–
– odczyn obojętny liczba H+ = OH–
– odczyn zasadowy liczba H+ < OH–
CO TO JEST PH ROZTWORU?
pH roztworu jest miarą kwasowości roztworu, zależną od stężenia jonów H+ w tym roztworze.
CZYM JEST SKALA PH?
Skala pH to skala liczbowa o zakresie od 0 do 14. Wartości liczbowe informują o stężeniu kationów wodoru w roztworze.
pH = 7 (odczyn obojętny)
pH < 7 (odczyn kwasowy)
– zwiększa się stężenie jonów H+
– zmniejsza się stężenie jonów OH–
– zwiększa się kwasowość roztworu
pH > 7 (odczyn zasadowy)
– zmniejsza się stężenie jonów H+
– zwiększa się stężenie jonów OH–
– zwiększa się zasadowość roztworu
ĆWICZENIA - SPRAWDŹ WIEDZĘ PRZED SPRAWDZIANEM
Przykładowe zestawienia zadań, które mogą być idealnym treningiem przed realnym sprawdzianem.
Pliki do pobrania w .pdf i wydrukowania TUTAJ